2016年,國家食品藥品監督管理總局(以下簡稱食品藥品監管總局)貫徹落實《醫療器械監督管理條例》,按照《國務院關於改革藥品醫療器械審評審批制度的意見》(國發〔2015〕44號),持續深入推進醫療器械審評審批制度改革工作,進一步加強對全國醫療器械註冊工作監督和管理,加大現場核查和真實性抽查力度,不斷提升醫療器械註冊審評審批的質量與效率。
一、醫療器械註冊工作情況
(一)醫療器械註冊管理法規體系逐步完善
釋出了《醫療器械臨床試驗質量管理規範》(國家食品藥品監管總局 中華人民共和國衛生和計劃生育委員會令第25號)、《醫療器械通用名稱命名規則》(國家食品藥品監管總局令第19號)、《醫療器械優先審批程式》(國家食品藥品監管總局公告2016年168號)、《免於進行臨床試驗的第二類醫療器械目錄(第二批)》和《免於進行臨床試驗的第三類醫療器械目錄(第二批)》(國家食品藥品監管總局通告2016年第133號)。
上述規章和規範性檔案的制修訂工作標誌我國醫療器械註冊管理法規體系逐步完善,為醫療器械註冊管理工作提供了制度保障,同時也為醫療器械企業註冊申報工作的有序開展提供了良好的法規基礎。
(二)醫療器械審評審批制度改革持續深入
2016年,食品藥品監管總局成立了醫療器械審評審批改革辦公室,制定2016年改革任務分解表,督促指導改革工作,各項改革任務有序推進。
1.食品藥品監管總局醫療器械技術審評中心建立健全審評質量管理體系和制度檔案,釋出實施《醫療器械註冊審評質量管理規範》,擴大專案小組審評範圍,對延續註冊申請單獨佇列,規範延續註冊的審查要求,完善溝通交流制度,規範專家諮詢,提高審評效率。
2.按照審評審批改革要求,推進分類管理改革,完成《醫療器械分類目錄(徵求意見稿)》,公開徵求意見,籌建醫療器械分類技術委員會各專業組。
3.積極推進醫療器械標準制修訂,確定《醫用電氣裝置 第2部分:輕離子束醫用電氣裝置的基本安全和基本效能專用要求》等106項醫療器械行業標準計劃專案,審定釋出外科植入物、消毒裝置等250項醫療器械行業標準,其中強制性標準48項,推薦性標準202項,併發布了1項標準修改單。
4.釋出第二批免於進行臨床試驗的醫療器械目錄,對267種第二類醫療器械、92種第三類醫療器械,合計359種醫療器械產品豁免臨床試驗,其中有15種體外診斷試劑產品,這也是體外診斷試劑產品首次列入免於進行臨床試驗目錄中。
5.臨床試驗真實性抽查力度不斷加大。組織2批醫療器械臨床試驗監督檢查,抽取20家企業的20個註冊申請專案,對涉及的40家臨床試驗機構進行檢查, 對8個存在真實性問題的註冊申請,作出不予註冊、自不予註冊之日起一年內不予再次受理的處理決定。共有122家企業主動撤回了263項醫療器械註冊申請。省局也主動開展了第二類醫療器械產品臨床試驗監督抽查。
通過現場監督檢查,強化了申請人和臨床試驗機構的法律意識、誠信意識、責任意識和質量意識,有力地規範醫療器械臨床試驗過程,打擊弄虛作假行為,起到了巨大的震懾作用。
6.各省級食品藥品監管部門,不斷加強省級審評審批能力提升工作,大力推進審評審批制度改革。部分省局出臺了針對創新等特殊第二類醫療器械的優先審批辦法,優化並簡化了第二類醫療器械的註冊流程,已有14個省份實施了註冊收費制度。
7.2016年12月29日,完成《關於調整部分醫療器械行政審批事項審批程式的決定》(公開徵求意見稿),並公開徵求意見。
(三)加強醫療器械註冊工作監督管理
2016年制修訂併發布了磁療產品、牙科種植體(系統)、可吸收縫線等52項醫療器械註冊技術審查指導原則,其中制定30項,修訂22項。針對目前醫療器械發展實際情況,釋出《醫療器械網路安全技術指導原則》有效地統一了相關審查要求,提升了對產品安全、有效性審查水平。同時,還部署了33個醫療器械註冊技術審查指導原則編寫專案。
繼續加強對省級醫療器械審評審批能力考核評估,修改完善審評審批能力考核評估指標,在各省自查基礎上,組織對10個省局進行現場考核評估。現場考核評估中,抽取卷宗進進行現場審查,並對常見問題進行分析彙總,有力促進省級食品藥品監管部門醫療器械註冊管理水平的提升。
二、醫療器械註冊申請受理情況
2016年,食品藥品監管總局共受理醫療器械註冊、延續註冊和許可事項變更申請8920項,與2015年相比註冊受理專案減少5.1%。
(一)整體情況
2016年,受理境內第三類醫療器械註冊申請3007項,受理進口醫療器械註冊申請5913項。
按註冊品種區分,醫療器械註冊申請5920項,體外診斷試劑註冊申請3000項。
按註冊形式區分,首次註冊申請1612項佔全部註冊申請的18%,延續註冊申請5402項佔全部註冊申請的61%,許可事項變更註冊申請1906項佔全部註冊申請的21%。註冊形式比例情況見圖1。
圖1.註冊形式比例圖
(二)分項情況
1.境內第三類醫療器械註冊受理情況
2016年,境內第三類醫療器械註冊受理共3007項,與2015年相比減少23%。其中,醫療器械註冊申請1899項,體外診斷試劑註冊申請1108項。
從註冊形式看,首次註冊864項佔全部境內第三類醫療器械註冊申請數量的29%,延續註冊1622項佔全部註冊申請數量的54%,許可事項變更521項佔全部註冊申請數量的17%。註冊形式分佈情況見圖2。
圖2.境內第三類註冊申請註冊形式分佈圖
2.進口第二類醫療器械註冊受理情況
2016年,進口第二類醫療器械註冊受理共3095項,與2015年相比增加2%。其中醫療器械註冊申請1690項,體外診斷試劑註冊申請1405項。
從註冊形式看,首次註冊449項佔全部進口第二類醫療器械註冊申請數量的15%,延續註冊2021項佔全部註冊申請數量的65%,許可事項變更625項佔全部註冊申請數量的20%。註冊形式分佈情況見圖3。
圖3.進口第二類註冊申請註冊形式分佈圖
3.進口第三類醫療器械註冊受理情況
2016年,進口第三類醫療器械註冊受理共2818項,與2015年相比增加15%。其中醫療器械註冊申請2331項,體外診斷試劑註冊申請487項。
從註冊形式看,首次註冊299項佔全部進口第三類醫療器械註冊申請數量的11%,延續註冊1759項佔全部註冊申請數量的63%,許可事項變更760項佔全部註冊申請數量的16%。註冊形式分佈情況見圖4。
圖4.進口第三類註冊申請註冊形式分佈圖
三、醫療器械註冊審評審批情況
2016年,食品藥品監管總局共完成醫療器械註冊申請技術審評9336項,與2015年相比增長0.25% 。其中,首次註冊 2427項,延續註冊5276項,許可事項變更1633項。截至2016年底,處於在審評狀態申請共5598項,其中,2247項處於發出補充材料通知單待補回狀態。
2016年,食品藥品監管總局共批准醫療器械註冊、延續註冊和許可事項變更註冊8653項。與2015年相比註冊批准總數量增長14.9%。
2016年食品藥品監管總局共對338項醫療器械註冊申請不予註冊,企業自行撤回310項。
近四年總局批准醫療器械註冊情況見圖5。
圖5.2013-2016年度註冊資料圖
(一)整體情況
2016年,總局批准境內第三類醫療器械註冊2902項,與2015年相比增加6%,進口醫療器械5751項,與2015年相比增加20%。
按照註冊品種區分,醫療器械5506項,體外診斷試劑3147項,二者比例約為7:4。
按照註冊式形區分,首次註冊1966項佔全部註冊的23%,延續註冊5221項佔全部註冊申請的60%,許可事項變更註冊1466項佔全部註冊申請的17%。註冊形式比例情況見圖6。
圖6.2016年註冊形式比例圖
(二)分項情況
1.境內第三類醫療器械審評審批情況
2016年境內第三類醫療器械註冊2902項。其中,醫療器械1661項,體外診斷試劑1241項。
從註冊形式看,首次註冊929項佔全部境內第三類醫療器械註冊申請數量的32%,延續註冊1510項佔全部註冊申請數量的52%,許可事項變更463項佔全部註冊申請數量的16%。註冊形式分佈情況見圖7。
圖7. 境內第三類醫療器械註冊形式分佈圖
2.進口第二類醫療器械審評審批情況
2016年,進口第二類醫療器械註冊3083項。其中,醫療器械註冊1535項,體外診斷試劑註冊1548項。
從註冊形式看,首次註冊444項佔全部進口第二類醫療器械註冊申請數量的14%,延續註冊2077項佔全部註冊申請數量的68%,許可事項變更562項佔全部註冊申請數量的18%。註冊形式分佈情況見圖8。
圖8. 進口第二類醫療器械註冊形式分佈圖
3.進口第三類醫療器械審評審批情況
2016年,進口第三類醫療器械註冊2668項。其中,醫療器械註冊2255項,體外診斷試劑註冊413項。
從註冊形式看,首次註冊593項佔全部進口第二類醫療器械註冊申請數量的22%,延續註冊1634項佔全部註冊申請數量的61%,許可事項變更441項佔全部註冊申請數量的17%。註冊形式分佈情況見圖9。
圖9. 進口第三類醫療器械註冊形式分佈圖
(三)首次註冊專案月度審批情況
2016年食品藥品監管總局共批准首次註冊醫療器械首次註冊共1966項,月度審批情況見圖10。
圖10.2016年度月度審批首次註冊醫療器械資料圖
(四)具體批准品種種類分析
從註冊資料看,體外診斷試劑在註冊產品中佔的比重大,其中,境內第三類醫療器械中,體外診斷試劑註冊數量佔全部註冊數量的43%,進口醫療器械中,體外診斷試劑註冊數量佔全部註冊數量的33%。
2016年,註冊的境內第三類醫療器械,除體外診斷試劑外,共涉及《醫療器械分類目錄》中28個子目錄中產品。
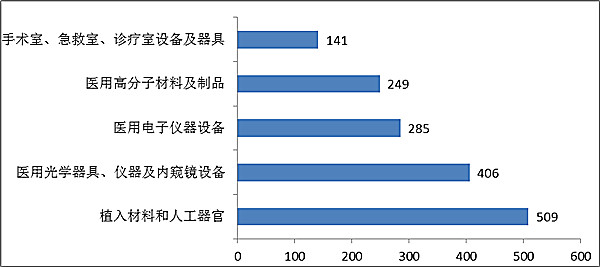
註冊數量前五位的境內第三類醫療器械是:植入材料和人工器官,醫用高分子材料及製品,注射穿刺器械,醫用光學器具、儀器及內窺鏡裝置,手術室、急救室、診療室裝置及器具。
與2015年相比,植入材料和人工器官類產品從第二位升至第一位,而手術室、急救室、診療室裝置及器具取代了介入器材進入前五。
圖11.境內第三類醫療器械註冊品種排點陣圖
2016年,註冊的進口醫療器械,除體外診斷試劑外,共涉及《醫療器械分類目錄》中39個子目錄中產品。
註冊數量前五位的進口醫療器械,主要是:植入材料和人工器官,醫用光學器具、儀器及內窺鏡裝置,醫用電子儀器裝置,醫用高分子材料及製品,手術室、急救室、診療室裝置及器具。
與2015年相比,同樣是植入材料和人工器官類產品從第二位升至第一位,而手術室、急救室、診療室裝置及器具取代口腔科材料進入前五。
圖12.進口醫療器械註冊品種排點陣圖
(五)進口醫療器械國別分析
2016年,美國、德國、日本、英國和韓國醫療器械在中國醫療器械註冊數量排前五位,與2015年相同,約佔2016年進口產品註冊總數量的73%。
圖13.進口醫療器械國別註冊排點陣圖
(六)境內第三類醫療器械省份分析
從2016年境內第三類醫療器械註冊情況看,相關注冊產品生產企業主要集中在沿海經濟較發達省份。
圖14.境內第三類醫療器械省份註冊分佈圖
其中,北京、江蘇、上海、廣東、浙江是境內第三類醫療器械註冊數量排前五名的省份,佔2016年境內第三類醫療器械註冊數量的69%。
圖15.境內第三類醫療器械註冊省份排點陣圖
四、創新醫療器械等產品審評審批情況
2016年,食品藥品監管總局按照《創新醫療器械特別審批程式(試行)》,繼續做好創新醫療器械審查工作,並批准了部分創新醫療器械產品上市。
2016年,食品藥品監管總局共收到創新醫療器械特別審批申請197項,組織專家審查175專案,完成144項審查(含2015年申請事項),確定45個產品進入創新醫療器械特別審批通道。批准註冊三維心臟電生理標測系統等10個產品上市。其中,有源醫療器械6項,無源醫療器械3項,體外診斷試劑1項。與2015相比總數增加1項。
這些創新產品核心技術都有我國的發明專利權或者發明專利申請已經國務院專利行政部門公開,產品主要工作原理/作用機理為國內首創,具有顯著的臨床應用價值。
(一)三維心臟電生理標測系統(國械注準20163770387,上海微創電生理醫療科技有限公司)。該產品是基於導管的對心房和心室進行電生理標測和定位的系統,與冷鹽水灌注射頻消融導管和體表參考電極聯合使用, 通過採集和分析心臟電生理活動,可實時顯示人體心臟三維圖形。
(二)呼吸道病原菌核酸檢測試劑盒(恆溫擴增晶片法)(國械注準20163400327,博奧生物集團有限公司)。該產品用於定性檢測痰液中8種臨床常見下呼吸道病原菌,包括:肺炎鏈球菌、金黃色葡萄球菌、耐甲氧西林葡萄球菌、肺炎克雷伯菌、銅綠假單胞菌、鮑曼不動桿菌、嗜麥芽窄食單胞菌、流感嗜血桿菌。
(三)植入式迷走神經刺激脈衝發生器套件(國械注準20163210989,北京品馳醫療裝置有限公司)、植入式迷走神經刺激電極導線套件(國械注準20163210990,北京品馳醫療裝置有限公司)。“植入式迷走神經刺激脈衝發生器套件”由脈衝發生器、測試電阻、力矩螺絲刀和控制磁鐵組成。“植入式迷走神經刺激電極導線套件”由電極、造隧道工具(包括穿刺工具和套管)和固定夾組成。上述兩個產品配合使用,對藥物不能有效控制的難治性癲癇患者能起到控制癲癇發作的作用。是迷走神經刺激治療癲癇病的首例國產產品。
(四)藥物洗脫外周球囊擴張導管(國械注準20163771020,北京先瑞達醫療科技有限公司) 。該產品為OTW型球囊擴張導管,由球囊、導管尖端、軸杆等元件組成,塗有矽酮潤滑塗層。該產品適用於股動脈及膕動脈的經皮腔內血管成形術(PTA)。
(五)冷鹽水灌注射頻消融導管(國械注準20163771040,上海微創電生理醫療科技有限公司)。該產品適用於進行基於導管的心內電生理標測,該產品可與其相容的ColumbusTM三維心臟電生理標測系統和體表參考電極配合使用,提供定位資訊;當與射頻消融儀聯合使用時,可用於藥物難治性持續性房顫的治療。
(六)胸骨板(國械注準20163461582,常州華森醫療器械有限公司)。該產品適用於成人胸骨正中切開術後胸骨內固定。單獨使用胸骨固定裝置時,至少使用四個胸骨固定裝置。如由於胸骨畸形等原因無法同時使用四個胸骨固定裝置時,需聯合使用胸骨扎絲和/或胸骨板進行固定。
(七)正電子發射及X射線計算機斷層成像裝置(國械注準20163332156,明峰醫療系統股份有限公司)。該產品組合了X射線計算機斷層掃描系統(CT)和正電子發射計算機斷層掃描系統(PET),提供生理和解剖資訊的配準與融合。該產品伽馬光子定位精確,訊號數字化處理及採集方法先進,其所生成的影像同時包括人體器官組織的功能資訊和解剖學資訊,相關資訊可用於腫瘤、腦部疾病及心血管疾病等診斷、治療以及療效評價等方面。
(八)人工晶狀體(國械注準20163221747,愛博諾德(北京)醫療科技有限公司)。該產品具有“後表面高凸”、“高次非球面”、“複雜面形獨立分離”、“邊緣等厚”和“具有肝素改性的疏水性丙烯酸酯材料”等特點,在國產人工晶狀體中屬首創。適用於成年患者無晶體眼和原發性角膜散光摘除白內障後的視力矯正,旨在改善遠視力,減少殘餘散光度並且減少對遠視力眼鏡的依賴。
(九)骨科手術導航定位系統(國械注準20163542280,北京天智航醫療科技股份有限公司)。該產品用於在脊柱外科和創傷骨科開放或經皮手術中以機械臂輔助完成手術器械或植入物的定位。該產品採用6自由度機械臂、相容2D和3D醫學影像等專利技術,各項效能指標達到國際同類產品水平,適用於採用創傷骨科空心螺釘內固定術和脊柱螺釘內固定術的患者,可以有效保證螺釘置入的精度,縮短手術時間,減少X線輻射損傷,減輕患者損傷。
食品藥品監管總局2016年還批准了部分有較好臨床應用前景的醫療器械產品註冊。如:
(一)結核分枝桿菌氟喹諾酮類藥物耐藥突變檢測試劑盒(熒光PCR熔解曲線法)(國械注準20163401457)、結核分枝桿菌鏈黴素耐藥突變檢測試劑盒(熒光PCR熔解曲線法)(國械注準20163401458)、結核分枝桿菌乙胺丁醇耐藥突變檢測試劑盒(熒光PCR熔解曲線法)(國械注準20163401459),上述三個體外診斷試劑產品均由廈門致善生物科技有限公司生產,是國產同類產品首次獲批,分別用於檢測結核分枝桿菌對氟喹諾酮類藥物耐藥性、鏈黴素藥物耐藥性或乙胺丁醇藥物耐藥性,可用於臨床上結核病的輔助診斷。這些產品上市,有利於對耐多藥結核病患者及時診治,從而更好地控制與治療結核病。
(二)琥珀醯丙酮和非衍生化多種氨基酸、肉鹼測定試劑盒(串聯質譜法)(國械注準20163401324)、衍生化多種氨基酸和肉鹼測定試劑盒(串聯質譜法)(國械注準20163401325),上述兩個體外診斷試劑產品均由廣州市豐華生物工程有限公司生產,是國產同類產品首次獲批,分別用於檢測新生兒濾紙幹血片樣本中的琥珀醯丙酮、多種氨基酸和肉鹼濃度及檢測新生兒濾紙幹血片樣本中的多種氨基酸和肉鹼濃度。除串聯質譜技術外,目前常規的實驗室方法尚無法檢測上述指標,該產品為臨床診斷遺傳性代謝病提供了可用方法。
(三)基因測序儀(國械注準20163402206,深圳華大基因生物醫學工程有限公司 )。該產品採用聯合探針錨定聚合測序技術,在臨床上用於對來源於人體樣本的脫氧核糖核酸(DNA)進行測序,以檢測基因變化,這些基因變化可能導致存在疾病或易感性。該儀器不用於人類全基因組的測序或從頭測序。
五、其他註冊管理情況
(一)境內第二類醫療器械註冊情況
2016年,各省級食品藥品監管部門共批准境內第二類醫療器械註冊15553項,與2015年相比增長26.4%。其中首次註冊5854項,延續註冊5885項,許可事項變更註冊3814項。
境內第二類醫療器械分項註冊情況見圖16。
圖16.境內第二類醫療器械註冊形式比例圖
從註冊情況看,北京、廣東、江蘇、浙江、山東、上海、河南七省(直轄市)註冊的境內第二類醫療器械數量較多。第二類醫療器械註冊具體資料見下表及圖17。
圖17.各省境內第二類醫療器械註冊資料圖
(二)第一類醫療器械備案情況
2016年,食品藥品監管總局依職責共辦理進口第一類醫療器械備案數量2511項,與2015年相比增長0.9%。
全國設區的市級食品藥品監管部門依職責共辦理境內第一類醫療器械備案數量11463項,與2015年相比下降15.2%。
(三)登記事項變更情況
2016年,食品藥品監管總局依職責共辦理進口第二、三類和境內第三類醫療器械登記事項變更7082項。與2015年相比增長51%。
其中,境內第三類醫療器械登記事項變更2636項,進口第二類、三類醫療器械登記事項變更4446項。
各省級食品藥品監管部門依職責共辦理境內第二類醫療器械登記事項變更7322項,與2015年相比增長39.3%。